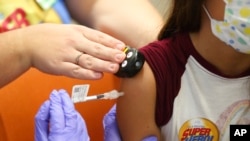
İlaç firmaları Pfizer ve BioNTech, ABD Gıda ve İlaç Dairesi’ne (FDA) ortak geliştirdikleri Covid-19 aşısının 5 yaş altı çocuklarda acil durumda kullanım başvurusu için veri iletmeye başladıklarını açıkladı.
Aşının klinik deneylerinde bu yaş grubu çocuklarda beklenenden düşük bağışıklık yanıtı oluştuğu görülmüştü.
Ancak şirketlerin açıklamasında FDA’in, acil kamu sağlığı krizine müdahale için bu yaş grubunun aşı denemesi verilerinin iletilmeye başlanmasını talep ettiği belirtildi.
FDA de bağımsız uzmanlardan oluşan bir komisyonun 15 Şubat’ta toplanarak 5 yaş altı çocuklara uygulanacak Pfizer/BioNTech aşısının acil durum kullanım iznini görüşeceklerini bildirdi.
Şirketler FDA’e aşının iki doz halinde yapılması için başvuru yapacak; ancak Pfizer’ın CEO’su Albert Bourla şirketin mevcut ve gelecekteki varyantlara karşı yüksek dozda koruma sağlanması için üç doz aşının gerekeceği görüşünde olduğunu söyledi.
Bourla, ‘‘İki doza onay verilmesi halinde aileler olası üçüncü doza verilecek onay beklenirken çocuklarını aşılatmaya başlayabilir’’ diye konuştu.
Şirketin iki dozluk aşı uygulaması için verilerini FDA’e iletmeyi gelecek günlerde tamamlaması bekleniyor. Bu aşamayı, üçüncü doz verilerinin iletilmesi izleyecek.
Pfizer ve BioNTech, bu yaş grubunda 3 mikrogram doz aşıyı deniyor. 5 ile 11 yaş arasına 10 mikrogram, 12 yaş ve üstüne ise 30 mikrogram doz aşı yapılıyor.
Küçük yaştaki çocukların aşı olmasına izin çıkmasının, karantina ve kapanmalarla boğuşan yuva ve anaokulu çocuklarının ailelerini rahatlatması bekleniyor.
Aralık ayında Pfizer 2 ile 4 yaş grubuna uygulanan iki doz aşının koruma oranının 16 ile 25 yaş aralığındakilere kıyasla daha düşük kalmasından dolayı iki doz aşıyla başlayan deneyini üç doza uyarlamaya başladığını açıklamıştı. 6 ay ile 2 yaş arasındaki çocuklarda ise aşı 16 ile 25 yaş arasındakilerde sağladığı korumanın benzerini sağlıyor.
Pfizer geçen ay yaptığı açıklamada deneyin sonuçlarını Nisan ayında alacağını bildirmişti.